Μεθυλολίθιο
Πρότυπο:Πληροφορίες χημικής ένωσης
Το μεθυλολίθιο[1] (αγγλικά methyllithium) είναι οργανική χημική ένωση, με εμπειρικό τύπο LiCH3. Συμβολίζεται, επίσης, συχνά με τη συντομογραφία MeLi, που προέρχεται από την αγγλόφωνη ονομασία του, MethylLithium). Είναι η απολούστερη οργανολιθιακή ένωση, δηλαδή μια οργανομεταλλική ένωση. Υιοθετεί μια ολιγομερική δομή, τόσο σε κατάσταση διάλυσης, όσο και στη στερεή κατάσταση της χημικά καθαρής ένωσης. Είναι πολύ δραστική ένωση και χρησιμοποποιείται διαλυμένη σε αιθέρες (ROR'), συνήθως σε άνυδρο διαιθυλαιθέρα (|Et2O|), στη συνθετική και (ιδιαίτερα) στην Οργανομεταλλική Χημεία. Οι σχετικές εφαρμογές που χρησιμοποιούν μεθυλολίθιο απαιτούν άνυδρες συνθήκες, γιατί η ένωση αντιδρά ζωηρά με το νερό (H2O). Το οξυγόνο (O2) και το διοξείδιο του άνθρακα (CO2) είναι επίσης ασύμβατα με το μεθυλολίθιο. Συνήθως το μεθυλολίθιο δεν παρασκευάζεται επιτόπου, αλλά παραγγέλνεται σε μορφή διαλύματος σε διάφορους αιθέρες.
Ονοματολογία
- Η ονομασία «μεθυλολίθιο» προκύπτει αν η ένωση θεωρηθεί ένωση λιθίου και μεθυλίου (CH3).
- Η ονομασία «λιθιομεθάνιο» προκύπτει αν η ένωση θεωρηθεί υποκατεστημένο μεθάνιο (CH4), δηλαδή ένα άτομο υδρογόνου έχει αντικατασταθεί από Li.
- Οι ονομασίες «λιθιομεθανίδιο» και «μεθανίδιο του λιθίου» ουσιαστικά είναι ταυτόσημες και προκύπτουν αν η ένωση θεωρηθεί (αφού άλλωστε όντως είναι) ετεροπολική ένωση μεταξύ κατιόντος λιθίου (Li+) και ανιόντος μεθανιδίου (CH3-). Η κατάληξη «-ίδιο» αντί «-άνιο» δηλώνει την ύπαρξη καρβανιόντος, δηλαδή αρνητικά φορτισμένου ανθρακούχου ιόντος.
Δομή
| Δεσμοί[2] | ||||
| Δεσμός | τύπος δεσμού | ηλεκτρονική δομή | Μήκος δεσμού | Ιονισμός |
|---|---|---|---|---|
| C-H | σ | 2sp³-1s | 109 pm | 3% C- H+ |
| C--Li+ | ετ. | 2(sp³)8-1s² | 231 pm | 100% C- Li+ |
| Κατανομή φορτίων σε ουδέτερο μόριο | ||||
| C | -1,09 | |||
| H | +0,03 | |||
| Li | +1,00 | |||
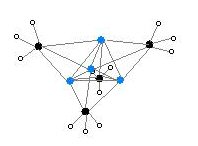
Δύο δομές μεθυλολιθίου έχουν πιστοποιηθεί με απλή κρυσταλλογραφία ακτίνων Χ και με φασματοσκοπία NMR 6Li, 7Li και 13C:
Η ισχύς του δεσμού C-Li έχει εκτιμηθεί γύρω στα 57 kcal/mol με φασματοσκοπικές μετρήσεις υπερύθρου[3].
Τετραμερής δομή
Τα δομικά συμπλέγματα της τετραμερούς δομής μεθυλολιθίου σχηματίζουν κύβους, στις κορυφές των οποίων τοποθετούνται εναλλάξ ιόντα Li+ και CH3-. Οι αποστάσεις Li-Li είναι περίπου 269 pm, δηλαδή σχεδόν ταυτόσημες με αυτές του αερίου διλιθίου (Li2). Οι αποστάσεις C-Li είναι 231 pm. Κάθε ανιόν άνθρακα (C-) συνδέεται με τρία (3) άτομα υδρογόνου (H), με κλασσικούς ομοιοπολικούς δεσμούς σ (1s - 2sp³), καθώς και με επίσης τρία (3) ιόντα λιθίου (Li+), με ετεροπολικές έλξεις, λόγω αντίθετων ηλεκτρικών φορτίων.[4]. Ο σχηματισμός μεθυλολιθίου σε αιθερικό περιβάλλον (δηλαδή με αντίδραση σε διάλυμα σε κάποιον αιθέρα) ευνοεί την τετραμερή δομή, που αντιπροσωπεύεται από τον τύπο (LiMe)4.
Εξαγωνική δομή
Τα δομικά συμπλέγματα της εξαμερούς δομής μεθυλολιθίου σχηματίζουν εξαγωνικά πρίσματα, στις κορυφές των οποίων τοποθετούνται εναλλάξ ιόντα Li+ και CH3-. Ο σχηματισμός μεθυλολιθίου σε μεθυλαλογονικό περιβάλλον (δηλαδή με απευθείας αντίδραση μεταλλικού λιθίου σε υγρό μεθυλαλογονίδιο και όχι σε διάλυμα μεθυλαλογονιδίου σε αιθέρα) ευνοεί την εξαμερή δομή, που αντιπροσωπεύεται από τον τύπο (LiMe)6.
Δεσμολογία
Αυτά τα δομικά συμπλέγματα θεωρούνται ότι έχουν «χάσμα οκτάβας», αφού δεν ακολουθούν τον «κανόνα οκτάβας», επειδή τα «μόρια» αυτά δεν έχουν αρκετά ηλεκτρόνια για να σχηματίσουν 4 δεσμούς γύρω από κάθε άτομο άνθρακα, σε αντιδιαστολή με τις περισσότερες οργανικές ενώσεις. Η εξαμερής δομή είναι μια «ένωση 30 ηλεκτρονίων»: Τα 18 κατανέμονται για τους ισχυρούς δεσμούς C-H και τα άλλα 12 απομένουν για τους δεσμούς Li-C και Li-Li. Υπάρχουν 6 ηλεκτρόνια για 6 διαμεταλλικούς δεσμούς και 1 ηλεκτρόνιο για κάθε αλληλεπίδραση μεθυλίου και η³-λιθίου.
Παραγωγή
Το μεθυλολίθιο παράγεται με επίδραση μεταλλικού λιθίου (Li) σε μεθυλαλογονίδιο (CH3X), συνήθως παρουσία άνυδρου διαιθυλαιθέρα (|Et2O|)[5]:
Αν χρησιμοποιηθεί το βρωμομεθάνιο (MeBr), όση ποσότητα από αυτό δεν πρόλαβε να αντιδράσει σχηματίζει ένα σύμπλοκο με το μεθυλολίθιο της δομής (MeBr...LiMe). Γι' αυτό, το περισσότερο μεθυλολίθιο που διακινείται εμπορικά περιέχει αυτό το σύμπλοκο. Η έκδοση «Halide free» (δηλαδή ελεύθερου από αλογονίδια) μεθυλολίθιου παράγεται με χρήση μεθυλοχλωριδίου (MeCl), ως μεθυλαλογονίδιο, που δε σχηματίζει ισχυρό σύμπλοκο με το μεθυλολίθιο και επιτρέπει το (σχετικά εύκολο) διαχωρισμό με διήθηση αρκετά καθαρού μεθυλολιθίου.[6].
Χημική δραστικότητα
Το μεθυλολίθιο είναι μια ισχυρή βάση κατά Lewis και ένα ισχυρό πυρηνόφιλο αντιδραστήριο, εξαιτίας του αρνητικού ηλεκτρικού φορτίου που εμφανίζει το άτομο άνθρακα (C). Γι' αυτό είναι ιδιαίτερα δραστικό έναντι δεκτών ηλεκτρονίων (δηλαδή οξέων κατά Lewis) και δοτών πρωτονίων (δηλαδή κλασσικών οξέων). Σε σύγκριση με το (δραστικότερο) βουτυλολίθιο (BuLi), το μεθυλολίθιο αντιδρά μόνο πολύ αργά με το τετραϋδροφουράνιο (ΤΗF), σε θερμοκρασία δωματίου (20 °C), και τα διαλύματά του σε αιθέρα είναι σταθερά επ' αόριστον. Με το νερό και τις αλκοόλες αντιδρά βίαια. Για λόγους ασφαλείας, οι περισσότερες αντιδράσεις, που χρησιμοποιούν μεθυλολίθιο, πραγματοποπιούνται σε θερμοκρασίες μικρότερες της θεμοκρασίας δωματίου (<20 °C). Παρόλο που το μεθυλολίθιο μπορεί να χρησιμοποιηθεί για αντιδράσεις αποπρωτονίωσης, για τέτοιες αντιδράσεις συνήθως προτιμάται το βουτυλολίθιο, γιατί είναι οικονομικότερο και πιο δραστικό.
Με νερό
Το μεθυλολίθιο αντιδρά βίαια με το νερό (H2O), παράγοντας υδροξείδιο του λιθίου (LiΟΗ) και μεθάνιο (CH4)[7]:
Με διοξείδιο του άνθρακα
Το μεθυλολίθιο αντιδρά με το διοξείδιο του άνθρακα (CO2), παράγοντας (τελικά με οξύνιση) αιθανικό οξύ (CH3COOH)[8]:
Με αλκυλαλογονίδια
Το μεθυλολίθιο αντιδρά με αλκυλαλογονίδια (RX), μεθυλιώνοντάς τα και παράγοντας μεθυλιωμένα αλκάνια (RMe)[9]:
Με οργανοπολυαλογονίδια
Το μεθυλολίθιο αντιδρά με οργανοπολυαλογονίδια, πολυμεθυλιώνοντάς τα και παράγοντας πολυμεθυλιωμένα αλκάνια. Π.χ.[9]:
Με αλκοόλες
Το μεθυλολίθιο αντιδρά βίαια με αλκοόλες (ROH), παράγοντας το αντίστοιχο αλκοολικό λίθιο (ROLi) και μεθάνιο (CH4)[10]:
Με μεθανάλη
Το μεθυλολίθιο αντιδρά με τη μεθανάλη (HCHO), μεθυλιώνοντάς τη και παράγοντας αιθανόλη (EtOH)[11]:
Με αλδεΰδες
Το μεθυλολίθιο αντιδρά με αλδεΰδες (RCHO), μεθυλιώνοντάς τες και παράγοντας δευτεροταγείς μεθυλαλκοόλες (RCH(OH)Me)[11]:
Με κετόνες
Το μεθυλολίθιο αντιδρά με κετόνες (RCOR'), μεθυλιώνοντάς τες και παράγοντας τριτοταγείς μεθυλαλκοόλες (RC(Me)(OH)R')[12]:
Με οξιράνιο
Το μεθυλολίθιο αντιδρά με το οξιράνιο, παράγοντας (τελικά με οξύνιση) 1-προπανόλη (CH3CH2CH2OH)[13]:
Με νιτρίλια
Το μεθυλολίθιο αντιδρά με νιτρίλια (RCN), μεθυλιώνοντάς τα και παράγοντας (τελικά με οξύνιση) μεθυλοκετόνες (RCOMe)[14]:
Με καρβοξυλικούς εστέρες
Το μεθυλολίθιο αντιδρά με καρβοξυλικούς εστέρες (RCOOR'), μεθυλιώνοντάς τες και παράγοντας μεθυλοκετόνες (RCOMe)[15]:
Με αλαμίνες
Το μεθυλολίθιο αντιδρά με αλαμίνες (π.χ. NH2X), μεθυλιώνοντάς τες και παράγοντας μεθυλαμίνες (π.χ. CH3NH2). Π.χ.[16]:
Με σιλυλαλογονίδια
Το μεθυλολίθιο αντιδρά με σιλυλαλογονίδια [SivH2v+1X], μεθυλιώνοντάς τα και παράγοντας μεθυλοσιλάνια [SivH2v+1CH3]. Π.χ.[17]:
Με φωσφυλαλογονίδια
Το μεθυλολίθιο αντιδρά με αλοφωσφίνες (π.χ. PH2X), μεθυλιώνοντάς τα και παράγοντας μεθυλοφωσφίννες (π.χ. CH3PH2). Π.χ.[18]:
Με τριαλογονίδια του φωσφόρου
Το μεθυλολίθιο αντιδρά με τριαλογονίδια του φωσφόρου (PX3), τριμεθυλιώνοντάς τα και παράγοντας τριμεθυλοφωσφίνη [(CH3)3P][19]:
Με πενταλογονίδια του φωσφόρου
Το μεθυλολίθιο αντιδρά με πενταλογονίδια του φωσφόρου (PX5), πενταμεθυλιώνοντάς τα, παράγοντας πενταμεθυλοφωσφoράνιο [(CH3)5P][20]:
Με χλωριούχο υδράργυρο
Το μεθυλολίθιο αντιδρά με αλογονούχο υδράργυρο (HgΧ2), διμεθυλιώνοντάς τον, παράγοντας διμεθυλοϋδράργυρο [Hg(CH3)2][21]:
Με χλωριούχο μόλυβδο
Το μεθυλολίθιο αντιδρά με το χλωριούχο μόλυβδο (PbCl2), τετραμεθυλιώνοντάς τον, παράγοντας τετραμεθυλομόλυβδο [Pb(CH3)4][22]:
Με τετραχλωριούχο ζιρκόνιο
Το μεθυλολίθιο αντιδρά με τετραχλωριούχο ζιρκόνιο (ZrCl4), εξαμεθυλιώνοντάς το και παράγοντας εξαμεθυλοζιρκονιούχο διλίθιο [Li2[Zr(CH3)6][23] :
Με μεθυλένιο
Το μεθυλολίθιο αντιδρά με μεθυλένιο ([:CH2]), σχηματίζοντας αιθυλολίθιο (EtLi)[24]:
Πηγές πληροφόρησης
- SCHAUM'S OUTLINE SERIES, «ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ», Μτφ. Α. Βάρβογλη, 1999
- «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982
- Αναστάσιου Βάρβογλη, «Χημεία Οργανικών Ενώσεων», Παρατηρητής, Θεσσαλονίκη 1991
- Καραγκιοζίδη Σ. Πολυχρόνη, «Ονοματολογία Οργανικών Ενώσεων στα Ελληνικά & Αγγλικά» Β΄ Έκδοση, Θεσσαλονίκη 1991
- Νικολάου Ε. Αλεξάνδρου, «Γενική Οργανική Χημεία», Εκδόσεις Ζήτη, Θεσσαλονίκη 1985
- Δημητρίου Ν. Νικολαΐδη, «Ειδικά Μαθήματα Οργανικής Χημείας», ΑΠΘ, θεσσαλονίκη 1983
- Νικολάου Ε. Αλεξάνδρου, Αναστάσιου Βάρβογλη, Φαίδωνα Χατζημηχαλάκη, «Εργαστηριακός Οδηγός», Εκδόσεις Ζήτη, Θεσσαλονίκη 1986
Παραπομπές
- ↑ Για εναλλακτικές ονομασίες δείτε τον πίνακα πληροφοριών.
- ↑ Τα δεδομένα προέρχονται εν μέρει από το «Table of periodic properties of thw Ellements», Sagrent-Welch Scientidic Company και Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, Σελ. 34. Ο ιονισμός βασίζεται στην ηλεκτραρνητικότητα κατά Paouling των στοιχείων.
- ↑ Brown, T. L.; Rogers, M. T. (1957). "The Preparation and Properties of Crystalline Lithium Alkyls". Journal of the American Chemical Society 79 (8): 1859–1861. doi:10.1021/ja01565a024.
- ↑ Elschenbroich, C. ”Organometallics” (2006) Wiley-VCH: Weinheim. ISBN 978-3-29390-6
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 268, §11.5Β
- ↑ Lusch, M. J.; Phillips, M. V.; Sieloff, W. V.; Nomura, G. S.; House, H. O.: Preparation of Low-Halide Methyllithium, collvol 7, collvolpages 346, 1990, prep cv7p0346.
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. §199, §8.4.1δ, με Li αντί MgX, Η αντί R.
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. §283, §12.2.1, με Li αντί MgX, CH3 αντί R.
- ↑ 9,0 9,1 «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. §152, §6.2.4, με Li αντί MgX.
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. §199, §8.4.1δ, με Li αντί MgX.
- ↑ 11,0 11,1 «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. §152, §8.2.4.1,, με Li αντί MgX.
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. §152, §8.2.4.1, με Li αντί MgX.
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. §152, §8.4.5.5, με Li αντί MgX.
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 226, §9.3.1β, με Li αντί MgX.
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 226, §9.3.1α, με Li αντί MgX.
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 248, §10.2.2γ, με Li αντί MgX.
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 267, §11.4Α, με Li αντί MgI και SiH3X αντί SiCl4.
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 267, §11.3.1, με Li αντί MgBr, CH3 αντί Φ και PH2X αντί PCl3.
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 267, §11.3.1, με Li αντί MgBr και CH3 αντί Φ και Χ αντί Cl.
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 267, §11.3.1, με Li αντί MgBr, CH3 αντί Φ και PΧ5 αντί PCl3.
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 268, §11.5Γ, με Li αντί MgCl, CH3 αντί R.
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 268, §11.5Δα, με Li αντί MgCl, CH3 αντί R.
- ↑ Morse, P. M.; Girolami, G. S. "Are d0 ML6 Complexes Always Octahedral? The X-ray Structure of Trigonal-Prismatic [Li(tmed)]2[ZrMe6]" Journal of the American Chemical Society 1989, 111, 4114-6. Πρότυπο:DOI
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 155, §6.7.3.