Βουτανάλη
Πρότυπο:Πληροφορίες χημικής ένωσης
Η βουτανάλη ή βουτυραλδεΰδη ή και βουτυρική αλδεΰδη (Πρότυπο:Lang-en) είναι οργανική χημική ένωση, που περιέχει άνθρακα, Οξυγόνο και Υδρογόνο, με μοριακό τύπο C4H8O, αν και συχνά γράφεται πιο αναλυτικά ως CH3CH2CH2CHO ή και (συντομογραφικά) PrCHO. Είναι μια από τις αλδεΰδες. Η χημικά καθαρή βουτανάλη, στις συνηθισμένες συνθήκες, δηλαδή σε θερμοκρασία 25 °C και πίεση 1 atm), είναι ένα άχρωμο υγρό, με έντονη οσμή ιδρωμένων ποδιών, και θερμοκρασία βρασμού (υπό πίεση 1 atm) τους 75 °C. Αποτελεί ενδιάμεσο προϊόν στην παρασκευή διαφόρων βιομηχανικών υλικών, όπως πρώτες ύλες διαφόρων εφαρμογών πλαστικοποίησης, ως διαλύτης, ή ως αντιαφριστικό πρόσθετο.
Ισομέρεια
Με βάση τον χημικό της τύπο, C4H8O, έχει τα ακόλουθα εικοσιπέντε (25) ισομερή:
- 1-βουτεν-1-όλη (ελάσσων ταυτομερές της βουτανάλης) με σύντομο συντακτικό τύπο CH3CH2CH=CHOH.
- 2-βουτεν-1-όλη ή 3-μεθυλαλλυλική αλκοόλη με σύντομο συντακτικό τύπο CH3CH=CHCH2OH.
- 3-βουτεν-1-όλη με σύντομο συντακτικό τύπο CH2=CHCH2CH2OH.
- 2-βουτεν-1-όλη (ελάσσων ταυτομερές της βουτανόνης) με σύντομο συντακτικό τύπο CH3CH2C(OH)=CH2.
- 2-βουτεν-2-όλη (ελάσσων ταυτομερές της βουτανόνης) με σύντομο συντακτικό τύπο CH3CH=C(OH)CH3.
- 3-βουτεν-2-όλη με σύντομο συντακτικό τύπο CH2=CHCH(OH)CH3.
- Μεθυλο-1-προπενόλη (ελάσσων ταυτομερές της μεθυλοπροπανάλης) με σύντομο συντακτικό τύπο (CH3)2C=CHOH.
- Μεθυλο-2-προπενόλη ή 2-μεθυλαλλυλική αλκοόλη με σύντομο συντακτικό τύπο CH2=C(CH3)CH2OH.
- Αιθυλοβινυλαιθέρας ή αιθοξυαιθένιο με σύντομο συντακτικό τύπο CH3CH2OCH=CH2.
- Μεθυλο-1-προπενυλαιθέρας ή 1-μεθοξυπροπένιο με σύντομο συντακτικό τύπο CH3OCH=CHCH3.
- Μεθυλο-2-προπενυλαιθέρας ή 3-μεθοξυπροπένιο με σύντομο συντακτικό τύπο CH3OCH2CH=CH2.
- Μεθυλο(μεθυλοβινυλ)αιθέρας ή 2-μεθοξυπροπένιο με σύντομο συντακτικό τύπο CH3OC(CH3)=CH2.
- Μεθυλοπροπανάλη (κύριο ταυτομερές) της μεθυλοπροπεν-1-όλης με σύντομο συντακτικό τύπο (CH3)2CHCHO.
- Βουτανόνη (κύριο ταυτομερές) της 2-βουτεν-2-όλης και της 2-βουτεν-3-όλης) με σύντομο συντακτικό τύπο CH3CH2COCH3.
- Κυκλοβουτανόλη με σύντομο συντακτικό τύπο
 .
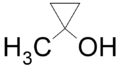
. - 1-μεθυλοκυκλοπροπανόλη με σύντομο συντακτικό τύπο
 .
. - 2-μεθυλοκυκλοπροπανόλη με σύντομο συντακτικό τύπο
 .
. - Κυκλοπροπυλομεθανόλη με σύντομο συντακτικό τύπο
 .
. - Κυκλοπροπυλομεθυλαιθέρας με σύντομο συντακτικό τύπο
 .
. - Οξολάνιο με σύντομο συντακτικό τύπο
 .
. - 2-μεθυλοξετάνιο με σύντομο συντακτικό τύπο
 .
. - 3-μεθυλοξετάνιο με σύντομο συντακτικό τύπο
 .
. - Αιθυλοξιράνιο με σύντομο συντακτικό τύπο
 .
. - 2,2-διμεθυλοξιράνιο με σύντομο συντακτικό τύπο
 .
. - 2,3-διμεθυλοξιράνιο με σύντομο συντακτικό τύπο
 .
.
Παραγωγή
Κύρια βιομηχανική μέθοδος
Η συνηθισμένη βιομηχανική μέθοδος παραγωγής της είναι με προσθήκη μεθανάλης (CO + H2) σε προπένιο. Η μέθοδος είναι γνωστή ως «υδροφορμυλίωση προπενίου»[1]:
- Παραδοσιακά, η υδροφορμυλίωση προπενίου για την παραγωγή βουτανάλης καταλύονταν αρχικά από σύμπλοκα κοβαλτίου - μονοξειδίου του άνθρακα, αλλά αργότερα ο χρησιμοποιούμενος καταλύτης αντικαταστάθηκε από σύμπλοκα ροδίου και τριφαινυλοφωσφίνης. Η επικρατούσα σχετική τεχνολογία περιλαμβάνει χρήση των ροδιούχων καταλυτών από το υδατοδιαλυτό αντιδραστήριο Tppts. Ένα υδατικό διάλυμα του παραπάνω αναφερόμενου ροδιούχου καταλύτη μετατρέπει το προπένιο σε βουτανάλη, που σχηματίζει μια ελαφρύτερη, μη αναμίξιμη με το νερό, υγρή φάση. Περίπου 6 εκατομμύρια τόνοι βουτανάλης παράγονται παγκοσμίως ανά έτος, με την παραπάνω αναψερόμενη διεργασία της υδροφορμυλίωσης προπενίου. Χρησιμοποιείται όμως και η παρακάτω αναφερόμενη μέθοδος της καταλυτικής αφυδρογόνωσης 1-βουτανόλης, ενώ παλαιότερα χρησιμοποιήθηκε και η μέθοδος υδρογόνωσης 2-βουυτενάλης, που παράγονταν με τη σειρά της από την αιθανάλη[2].
- Χρειάζεται σχετικά ογκώδης καταλύτης, για να ευνοηθεί ο σχηματισμός βουτανάλης και όχι της ισομερούς της μεθυλοπροπανάλης.
Εναλλακτικές μέθοδοι
Με επίδραση προπυλομαγνησιοαλογονίδιου σε φορμικό εστέρα
Με επίδραση προπυλομαγνησιοαλογονίδιου σε φορμικό εστέρα[3]:
Με μερική οξείδωση 1-βουτανόλης
Με μερική οξείδωση 1-βουτανόλης, με σχετικά ήπια οξειδωτικά μέσα, όπως το τριοξείδιο του χρωμίου[4]:
Με έμμεση μερική αναγωγή βουτανικού οξέος
1. Αρχικά το βουτανικό οξύ μετατρέπεται σε βουτανοϋλοχλωρίδιο[5]:
2. Το βουτανοϋλοχλωρίδιο ανάγεται καταλυτικά άμεσα προς βουτανάλη:
Με οζονόλυση 4-οκτένιου
Με οζονόλυση 4-οκτενίου παράγεται τελικά βουτανάλη[6]:
Με επίδραση υπεριωδικού οξέος σε 4,5-οκτανοδιόλη
Με επίδραση υπεριωδικού οξέος σε 4,5-οκτανοδιόλη παράγεται βουτανάλη[7]:
Χημικές ιδιότητες και παράγωγα
Όταν η βουτανάλη εκτίθεται στον ατμοσφαιρικό αέρα οξειδώνεται από το ατμοσφαιρικό οξυγόνο σε βουτανικό οξύ.
Ταυτομέρεια με 1-βουτεν-1-όλη
Η βουτανάλη βρίσκεται πάντα σε χημική ισορροπία με την ταυτομερή της 1-βουτεν-1-όλη. Μπορεί να καταλυθεί προς την επιθυμητή κατεύθυνση με παρουσία οξέων ή βάσεων[8]:
Αναγωγή προς 1-βουτανόλη
Μπορεί να αναχθεί προς 1-βουτανόλη με τις ακόλουθες μεθόδους[9]
1. Με λιθιοαργιλιοϋδρίδιο (LiAlH4):
2. Με καταλυτική υδρογόνωση:
Αναγωγή προς βουτάνιο
Μπορεί να αναχθεί προς βουτάνιο με τη μέθοδο Wolff-Kishner[10]
Οξείδωση προς βουτανικό οξύ
Μπορεί να οξειδωθεί προς βουτανικό οξύ[11];
1. Με υπερμαγγανικό κάλιο:
2. Με τριοξείδιο του χρωμίου:
3. Με οξυγόνο:
4. Με αντιδραστήριο Tollens (αμμωνιακό διάλυμα νιτρικού αργύρου):
5. Με αντιδραστήρια Fehling:
- Οι αντιδράσεις 4-5 παρουσιάζονται απλοποιημένες και χρησιμοποιούνται γενικά για την ανίχνευση αλδεϋδομάδας (-CHO).
Οξείδωση προς 2-οξοβουτανάλη
Μπορεί να οξειδωθεί προς 2-οξοβουτανάλη με χρήση διοξειδίου του σεληνίου[12]
Προσθήκη ύδατος
Με προσθήκη ύδατος σε προπανάλη παράγεται, σε χημική ισορροπία, η μη απομονώσιμη ασταθής 1,1-βουτανοδιόλη[13]:
Προσθήκη 1,2-αιθανοδιόλης
Με προσθήκη 1,2-αιθανοδιόλης παράγεται 2-προπυλο-1,3-διοξολάνιο[14]:
Προσθήκη 1,2-αιθανοδιθειόλης
Με προσθήκη 1,2-αιθανοδιθειόλης παράγεται 2-προπυλο-1,3-διθειολάνιο[14]:
- Το 2-προπυλο-1,3-διθειολάνιο μπορεί να υποστεί αποθείωση Raney με νικέλιο και υδρογόνο, σχηματίζοντας βουτάνιο και αιθάνιο:
Αντιδράσεις με αζωτούχες ενώσεις
Αντιδρά με αρκετά είδη αζωτούχων ενώσεων του γενικού τύπου NH2A, όπου το A μπορεί να είναι υδρογόνο, αλκύλιο, υδροξύλιο, αμινοξάδα και διάφορα άλλα. Με βάση τον γενικό τύπο η γενική αντίδραση είναι η ακόλουθη[15]:
- Μερικά σχετικά παραδείγματα αμέσως παρακάτω:
1. Με αμμωνία παράγεται 1-βουτανιμίνη. Προκύπτει από την παραπάνω γενική με A = H:
2. Με πρωτοταγείς αμίνες (RNH2) παράγεται Ν-αλκυλο-1-βουτανιμίνη. Προκύπτει από την παραπάνω γενική με A = R:
3. Με υδροξυλαμίνη παράγεται 1-βουτανοξίμη. Προκύπτει από την παραπάνω γενική με A = OH:
4. Με υδραζίνη παράγεται αρχικά 1-βουτανυδραζόνη και με περίσσεια βουτανάλης διβουτυλιδεναζίνη. Προκύπτει από την παραπάνω γενική με A = NH2:
5. Με φαινυλυδραζίνη παράγεαι 1-βουτυλιδενο-2-φαινυλυδραζόνη. Προκύπτει από την παραπάνω γενική με A = NHPh::
6. Με υδραζινομεθαναμίδιο παράγεται (2-βουτυλιδενυδραζινο)μεθαναμίδιο. Προκύπτει από την παραπάνω γενική με A = NCONH2:
Συμπύκνωση με δευτεροταγείς αμίνες
Με επίδραση δευτεροταγούς αμίνης (RNHR') παράγεται αρχικά 1-(διαλκυλαμινο)-1-βουτανόλη, η οποία στη συνέχεια με αφυδάτωση μπορεί να δώσει Ν,Ν-διαλκυλο-1-βουτεν-1-αμίνη[16]:
Αλδολική συμπύκνωση
Με επίδραση βάσης έχουμε τη λεγόμενη αλδολική συμπύκνωση, η οποία όταν γίνεται με τον εαυτό της, παράγεται αρχικά 2-προπυλο-3-υδροξυεξανάλη, η οποία στη συνέχεια με αφυδάτωση μπορεί να δώσει 2-προπυλο-2-εξενάλη[17]:
Συμπύκνωση με α-αλεστέρες
Με επίδραση α-αλεστέρων (R'CHXCOOR) έχουμε την αντίδραση Darzen, κατά την οποία τελικά παράγεται 2-προπυλο-1-καρβαλκοξυοξιράνιο. Π.χ. με αλαιθανικό αλκυλεστέρα (XCH2COOR) έχουμε[18]:
Συμπύκνωση με «ενεργές» μεθυλενομάδες
Με την επίδραση «ενεργών» μεθυλενομάδων, δηλαδή ενώσεων του γενικού τύπου XCH2Y, όπου X,Y ηλεκτραρνητικές ομάδες όπως π.χ. κυανομάδα (CN), καρβαλκοξυομάδα (COOR), έχουμε την αντίδραση Knoevenagel[19]:
Επίδραση φωσφοροϋλιδίων
Με επίδραση φωσφοροϋλιδίων [Ph3P+C-(R)R'] έχουμε τη λεγόμενη αντίδραση Wittig, με την οποία παράγεται 1,1-διαλκυλοπεντένιο-1[20]:
Προσθήκη διαφόρων πυρηνόφιλων αντιδραστηρίων
Είναι δυνατή η προσθήκη διαφόρων πυρηνόφιλων αντιδραστηρίων στον διπλό δεσμό C=Ο που περιέχει η βουτανάλη. Π.χ.:[21]:
1. Με προσθήκη υδροκυανίου παράγεται αρχικά 2-υδροξυπεντανονιτρίλιο, από το οποίο με υδρόλυση μπορεί να παραχθεί 2-υδροξυπεντανικό οξύ:
2. Με προσθήκη όξινου θειικού νατρίου παράγεται 1-υδροξυ-1-βουτανοσουλφονικό οξύ:
3. Με προσθήκη αλκυλομαγνησιοαλογονιδίου (RMgX) παράγεται 1-αλκυλο-1-βουτανόλη:
4. Με προσθήκη πενταχλωριούχου φωσφόρου παράγεται 1,1-διχλωροβουτάνιο:
Αλογόνωση
Με επίδραση αλογόνου (X2) έχουμε προσθήκη του στην ταυτομερή 1-βουτεν-1-όλη. Παράγεται αρχικά η ασταθής 1,2-διαλο-1-βουτανόλη που αφυδραλογονώνεται σχηματίζοντας τελικά 2-αλοβουτανάλη[22]:
Επίδραση υδραζωτικού οξέος
Με επίδραση υδραζωτικού οξέος (αντίδραση Achmidt) παράγεται βουτανονιτρίλιο και προπυλαμινομεθανάλη[23]:
Προσθήκη αλκοολών
Με προσθήκη αλκοόλης (ROH) παράγεται αρχικά 1-αλκοξυ-1-βουτανόλη και έπειτα, με περίσσεια αλκοόλης 1,1-διαλκοξυβουτάνιο[24]:
Αντίδραση Stracker
Με επίδραση υδροκυανίου (HCN) και αμμωνίας (NH3) σε βουτανάλη παράγεται αρχικά 2-αμινοπεντανονιτρίλιο και στη συνέχεια, με υδρόλυση, 2-αμινοπεντανικό οξύ (ένα μη πρωτεϊνικό αμινοξύ)[25]:
Φωτοχημική προσθήκη σε αλκένια
Με επίδραση βουτανάλης σε αιθένιο σχηματίζεται φωτοχημικά 2-προπυλοξετάνιο (Αντίδραση Paterno–Büchi)[26] [27]:
Επίδραση καρβενίων
Παρεμβολή καρβενίων, π.χ. με μεθυλενίου παράγονται πεντανάλη, 2-μεθυλοβουτανάλη, 3-μεθυλοβουτανάλη, 2-πεντανόνη και προπυλοξιράνιο[28]:
Αναφορές και σημειώσεις
- ↑ Πρότυπο:Cite book
- ↑ Boy Cornils, Richard W. Fischer, Christian Kohlpaintner "Butanals" in Ullmann's Encyclopedia of Industrial Chemistry, 2000, Wiley-VCH, Weinheim. doi:10.1002/14356007.a04_447.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.216, §9.2.1.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.216, §9.2.2.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.216, §9.2.3.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.216, §9.2.4.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.216, §9.2.6.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.218, §9.5.1.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.218, §9.5.2.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.218, §9.5.3α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.221, §9.6.1,2.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.218, §9.5.4.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.218, §9.5.5α.
- ↑ 14,0 14,1 Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.218, §9.5.5β.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.218-219, §9.5.6.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.219, §9.5.7.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.219, §9.5.8. και SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999, σελ. 268, §15.3.8
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.219, §9.5.10.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.219, §9.5.9.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.219, §9.5.11.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.220, §9.5.12.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.220, §9.5.13.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.220, §9.5.15.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.221, §9.6.3.
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 329, §14.2.2.
- ↑ Πρότυπο:Cite journal
- ↑ Πρότυπο:Cite journal
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 155, §6.7.3.
Πηγές
- Γ. Βάρβογλη, Ν. Αλεξάνδρου, Οργανική Χημεία, Αθήνα 1972
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982
- Δημήτριου Ν. Νικολαΐδη: Ειδικά μαθήματα Οργανικής Χημείας, Θεσσαλονίκη 1983.

