Μεθυλο-2-χλωροπροπάνιο
Πρότυπο:Πληροφορίες χημικής ένωσης
To μεθυλο-2-χλωροπροπάνιο ή τριτοταγές βουτυλοχλωρίδιο είναι ένα άχρωμο υγρό (στις συνηθισμένες συνθήκες, T = 25 °C, P = 1 atm) . Με βάση το χημικό τύπο του, C4H9Cl, έχει τα ακόλουθα τρία (3) ισομερές θέσης:
Είναι ελάχιστα αναμείξιμο κσι μόνο σε κολλοειδή διασπορά με το νερό, από το οποίο έχει την τάση να υφίσταται μια αργή υδρόλυση, σχηματίζοντας 2-μεθυλο-2-προπανόλη. Η ένωση είναι εύφλεκτη και πτητική και η κύρια χρήση της είναι ως αρχική ουσία για να δώσει αντιδράσεις πυρηνόφιλης υποκατάστασης, για την παραγωγή πολλών και διαφόρων παραγώγων (δείτε παρακάτω για λεπτομέρειες).
Όταν το μεθυλο-2-χλωροπροπάνιο αναμιγνύεται με το νερό, έναν πολικό και πρωτικό διαλύτη, μια αργή πυρηνόφιλη υποκατάσταση αρχίζει, με τον SN1 μηχανισμό, δηλαδή αρχίζοντας με μια διάσταση της μορφής:
Τελικά το τριτοταγές βουτυλοκατιόν που σχηματίζεται ενώνεται με το OH του νερού και απομένει υδροχλωρικό οξύ σε διάσταση:
Αυτά βέβαια ισχύουν όταν υπάρχουν μόνο νερό και μεθυλο-2-χλωροπροπάνιο στο μίγμα, γιατί αν συνυπάρχει κάποιο ισχυρότερο πυρηνόφιλο αντιδραστήριο από το νερό, το τελικό αποτέλεσμα δεν είναι 2-μεθυλο-2-προπανόλη, γιατί το τριτοταγές βουτυλοκατιόν ενώνεται με το ισχυρότερο πυρηνόφιλο.
Ονοματολογία
Η ονομασία «μεθυλο-2-χλωροπροπάνιο» προέρχεται από την ονοματολογία κατά IUPAC. Συγκεκριμένα, το πρόθεμα «προπ-» δηλώνει την παρουσία τριών (3) ατόμων άνθρακα ανά κύρια αλυσίδα της ένωσης, το ενδιάμεσο «-αν-» δείχνει την παρουσία μόνο απλών δεσμών μεταξύ ατόμων άνθρακα στο μόριο και η κατάληξη «-ιο» φανερώνει ότι δεν περιέχει χαρακτηριστικές ομάδες που έχουν χαρακτηριστικές καταλήξεις. Το πρόθεμα «χλωρο-» δηλώνει την παρουσία ενός (1) ατόμου χλωρίου ανά μόριο της ένωσης. Το αρχικό πρόθεμα «μεθυλο-» δηλώνει την παρουσία διακλάδωσης ενός ατόμου άνθρακα. Ο αριθμός θέσης «-2-», δηλώνει τον αριθμό θέσης του ατόμου του άνθρακα με το οποίο ενώνεται το άτομο του χλωρίου, για να διαχωριστεί η ένωση από την ισομερή της μεθυλο-1-χλωροπροπάνιο. Για το αρχικό πρόθεμα δεν χρειάζεται αριθμός θέσης, γιατί μόνο η θέση #2 είναι διαθέσιμη και επομένως εννοείται. Τέλος το πρόθεμα μέθυλο- προτάσσεται του προθέματος χλωρο-, γιατί μ < χ, σύμφωνα με την ελληνική αλφαβητική σειρά. Σημειώνεται ότι η αγγλόφωνη ονομασία της ένωσης είναι 2-chloromethylpropane, γιατί σύμφωνα με την αγγλική αλφάβητο είναι c < m.
Μοριακή δομή
| Δεσμοί[1] | ||||
| Δεσμός | τύπος δεσμού | ηλεκτρονική δομή | Μήκος δεσμού | Ιονισμός |
|---|---|---|---|---|
| C-H | σ | 2sp3-1s | 109 pm | 3% C- H+ |
| C-C | σ | 2sp3-2sp3 | 154 pm | |
| C-Cl | σ | 2sp3-3sp3 | 176 pm | 9% C+ Cl- |
| Κατανομή φορτίων σε ουδέτερο μόριο | ||||
| Cl | -0,09 | |||
| H | +0,03 | |||
| C#2 | +0,09 | |||
| C#1,#3,#1΄ | -0,09 | |||
Παραγωγή
Με φωτοχημική χλωρίωση
Με φωτοχημική χλωρίωση μεθυλοπροπανίου παράγεται μίγμα μεθυλο-2-χλωροπροπανίου και μεθυλο-1-χλωροπροπανίου[2]:
- Ακολουθεί το συνηθισμένο μηχανισμό φωτοχημικής αλογόνωσης αλκανίων. Παράγονται και πολυχλωροπαράγωγα. Η συγκέντρωση των τελευταίων περιορίζεται με χρήση περίσσειας μεθυλοπροπανίου.
- Η αναφερόμενη στοιχειομετρική αναλογία παραγωγής χλωροβουτανίων δεν συνυπολογίζει τα συμπαραγόμενα πολυχλωροπαράγωγα.
- Η μέθοδος δεν είναι χρήσιμη αν επιθυμείται το ένα μόνο ισομερές, αφού είναι σχετικά δύσκολος διαχωρισμός.
Με υποκατάσταση υδροξυλίου από χλώριο
1. Με επίδραση υδροχλωρίου (HCl) σε μεθυλο-2-προπανόλη ((CH3)3COH)[3]:
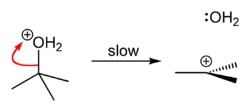
- Η αντίδραση είναι η αντίστροφη πυρηνόφιλη υποκατάσταση της παραπάνω αναφερόμενης υδρόλυσης, η οποία αντιστρέφεται σε όξινο περιβάλλον. Ο μηχανισμός αποδίδεται με το ακόλουθο σχήμα:
 |
 |
 |
2. Η υποκατάσταση του OH από Cl στην μεθυλο-2-προπανόλη μπορεί να γίνει και με χλωριωτικά μέσα[4]:
- 1. Με πενταχλωριούχο φωσφόρο (PCl5):
- 2. Με τριχλωριούχο φωσφόρο (PCl3):
- 3. Με θειονυλοχλωρίδιο (SOCl2):
Με προσθήκη υδροχλωρίου σε μεθυλοπροπένιο
Με προσθήκη υδροχλωρίου σε μεθυλοπροπένιο παράγεται μεθυλο-2-χλωροπροπάνιο[5]:
Χημικές ιδιότητες και παράγωγα
Αντιδράσεις υποκατάστασης
- Οι αντιδράσεις έχουν παρόμοια ταχύτητα σε σύγκριση με τα αντίστοιχα αλκυλαλογονίδια των άλλων αλογόνων, γιατί ο μηχανισμός που επικρατεί σ' αυτές τις αντιδράσεις υποκαταστάσεως είναι ο SN1.
Υποκατάσταση από υδροξύλιο
Κατά την υδρόλυσή του με εναιώρημα υδροξειδίου του αργύρου (AgOH) σχηματίζεται μεθυλο-2-προπανόλη ((CH3)3COH)[6]:
Υποκατάσταση από αλκοξύλιο
Με αλκοολικά άλατα (RONa) σχηματίζει 2-αλκοξυμεθυλοπροπάνιο ((CH3)3COR)[6]:
Υποκατάσταση από αλκινύλιο
Με αλκινικά άλατα (RC≡CNa) σχηματίζει αλκίνιο (RC≡CC(CH3)3). Π.χ.[6]:
Υποκατάσταση από ακύλιο
Με καρβονικά άλατα (RCOONa) σχηματίζει καρβονικό τριτοταγή βουτυλεστέρα (RCOOC(CH3)3)[6]:
Υποκατάσταση από κυάνιο
Με κυανιούχο νάτριο (NaCN) σχηματίζει διμεθυλοπροπανονιτρίλιο ((CH3)3CCN)[6]:
Υποκατάσταση από αλκύλιο
Με αλκυλολίθιο (RLi) σχηματίζει αλκάνιο[6]:
Υποκατάσταση από σουλφυδρίλιο
Με όξινο θειούχο νάτριο (NaSH) σχηματίζει μεθυλο-2-προπανοθειόλη ((CH3)3CSH)[6]:
Υποκατάσταση από σουλφαλκύλιο
Με θειολικό νάτριο (RSNa) σχηματίζει 2-αλκυλθειομεθυλοπροπάνιο ((CH3)3CSR)[6]:
Υποκατάσταση από ιώδιο
Με ιωδιούχο νάτριο (NaI) σχηματίζει μεθυλο-2-ιωδοπροπάνιο ((CH3)3CI)[6]:
Υποκατάσταση από φθόριο
Με επίδραση φθοριούχου υφυδραργύρου (Hg2F2) σε μεθυλο-2-χλωροπροπάνιο (CH3)3CCl) παράγεται μεθυλο-2-φθοροπροπάνιο[7][8]:
Υποκατάσταση από αμινομάδα
Με αμμωνία (NH3) σχηματίζει μεθυλο-2-προπαναμίνη ((CH3)3CNH2)[6]:
Υποκατάσταση από αλκυλαμινομάδα
Με πρωυτοταγείς αμίνες (RNH2) σχηματίζει N-αλκυλομεθυλο-2-προπαναμίνη (RNHC(CH3)3)[6]:
Υποκατάσταση από διαλκυλαμινομάδα
Με δευτεροταγείς αμίνες (R'NHR) σχηματίζει N,N-διαλκυλομεθυλο-2-προπαναμίνη [R'N(C(CH3)3)R][6]:
Υποκατάσταση από τριαλκυλαμινομάδα
Με τριτοταγείς αμίνες [R'N(R)R"] σχηματίζει χλωριούχο N,N,N-τριαλκυλο-τριτοταγές βουτυλαμμώνιο {[R'N(C(CH3)3)(R)R"]Cl}[9]:
Υποκατάσταση από φωσφύλιο
Με φωσφίνη σχηματίζει μεθυλο-2-προπανοφωσφαμίνη[10]:
Υποκατάσταση από νιτροομάδα
Με νιτρώδη άργυρο (AgNO2) σχηματίζει μεθυλο-2-νιτροπροπάνιο ((CH3)3CNO2)[11]:
Υποκατάσταση από φαινύλιο
Με επίδραση τύπου Clriedel-Crafts σε βενζολίου παράγεται μεθυλο-2-φαινυλοβενζόλιο:
Παραγωγή οργανομεταλλικών ενώσεων
1. Με λίθιο (Li σχηματίζει τριτοταγές βουτυλολίθιο[12]:
2. Με μαγνήσιο (Mg) σχηματίζει τριτοταγές βουτυλομαγνησιοχλωρίδιο [13]:
Αναγωγή
1. Με λιθιοαργιλλιοϋδρίδιο (LiAlH4) παράγεται μεθυλοπροπάνιο.[14]:
2. Με «υδρογόνο εν τω γενάσθαι», δηλαδή μέταλλο + οξύ παράγεται μεθυλοπροπάνιο.[15]:
3. Με σιλάνιο, παρουσία τριχλωριούχου βορίου, παράγεται μεθυλοπροπάνιο[16]:
4. Αναγωγή από ένα αλκυλοκασσιτεράνιο. Π.χ.[17]:
Αντιδράσεις προσθήκης
1. Σε αλκένια. Π.χ. με αιθένιο (CH2=CH2) παράγει 3,3-διμεθυλο-1-χλωρβουτάνιο ((CH3)3CCH2CH2Cl)[18]:
2. Σε αλκίνια. Π.χ. με αιθίνιο (HC≡CH) παράγει 3,3-διμεθυλο-1-χλωρο-1-βουτένιο ((CH3)3CCH=CHCl)[19]:
3. Η αντίδραση του μεθυλο-2-χλωροπροπανίου με συζυγή αλκαδιένια αντιστοιχεί κυρίως σε 1,4-προσθήκη, αν και είναι επίσης δυνατές η 1,2-προσθήκη και η 3,4-προσθήκη, με τη χρήση κατάλληλων συνθηκών. Π.χ[20]:
(1,4-προσθήκη)
(1,2-προσθήκη)
(3,4-προσθήκη)
4. Σε κυκλοαλκάνια που έχουν τριμελή ή τετραμελή δακτύλιο. Π.χ. με κυκλοπροπάνιο παράγει 4,4-διμεθυλο-1-χλωορπεντάνιο[21]:
5. Σε ετεροκυκλικές ενώσεις που έχουν τριμελή ή τετραμελή δακτύλιο. Π.χ. με εποξυαιθάνιο παράγει τυριτοταγές βουτοξυ-2-χλωραιθάνιο[22]:
Αντίδραση απόσπασης
Με απόσπαση υδροχλωρίου (HCl) από μεθυλο-2-χλωροπροπάνιο παράγεται μεθυλοπροπένιο[23]:
Παρεμβολή καρβενίων
- Προκύπτει πάντα ένα μόνο προϊόν. Συγκεκριμένα, αν χρησιμοποιηθεί μεθυλένιο παράγεται μόνο το 2-μεθυλο-2-χλωροβουτάνιο.
Σημειώσεις και αναφορές
- ↑ Τα δεδομένα προέρχονται εν μέρει από το «Table of periodic properties of thw Ellements», Sagrent-Welch Scientidic Company και Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, Σελ. 34.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 155, §6.7.2, R = (CH3)3C, (CH3)2CHCH2, X = Cl.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 185, §7.2.1, R = (CH3)2CHCH2, X = Cl.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 185, §7.2.2, R = (CH3)3C.
- ↑ SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999, §6.3., σελ. 79, για Ε = Η και Nu = Cl.
- ↑ 6,00 6,01 6,02 6,03 6,04 6,05 6,06 6,07 6,08 6,09 6,10 6,11 Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 186, §7.3.1.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 185, §7.2.8.
- ↑ Πραγματοποιείται και με υποκατάσταση βρωμίου ή ιωδίου, αλλά πιο αργά και δύσκολα.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 243, §10.2.Α, R = C(CH3)3, X = Cl.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 267, §11.3.Α1, R = C(CH3)3, X = Cl.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 244, §10.3.Α, R = (CH3)3C, X = Cl.
- ↑ Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991, §5.1. σελ.82
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 187, §7.3.5, R = (CH3)3C, X = Cl.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 187, §7.3.3α, R = (CH3)3C, X = Cl.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 187, §7.3.3β, R = (CH3)3C, X = Cl.
- ↑ Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991, σελ. 291-293, §19.1.
- ↑ SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999, Σελ. 42, §4.3.
- ↑ SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999, §6.3., σελ. 79, για Ε = (CH3)3C και Nu = Cl.
- ↑ SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999, §6.3., σελ. 79, εφαρμογή για αλκίνια και για Ε = (CH3)3C και Nu = Cl με βάση και την §8.1, σελ. 114-116.
- ↑ SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999, §6.3., σελ. 79, εφαρμογή για αλκαδιένια και για Ε = (CH3)3C και Nu = Cl με βάση και την §8.2, σελ. 116-117.
- ↑ SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999, §6.3., σελ. 79, εφαρμογή για κυκλοαλκάνια και για Ε = (CH3)3C και Nu = Cl σε συνδυασμό με Ν. Αλεξάνδρου, Α. Βάρβογλη, Δ. Νικολαΐδη: Χημεία Ετεροχημικών Ενώσεων, Θεσσαλονίκη 1985, §1.2., σελ. 22-25
- ↑ Ν. Αλεξάνδρου, Α. Βάρβογλη, Δ. Νικολαΐδη: Χημεία Ετεροχημικών Ενώσεων, Θεσσαλονίκη 1985, §2.1., σελ. 16-17, εφαρμογή γενικής αντίδρασης για Nu = Cl.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.153, §6.3.1α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 155, §6.7.3.
Πηγές
- Γ. Βάρβογλη, Ν. Αλεξάνδρου, Οργανική Χημεία, Αθήνα 1972
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982
- Ν. Αλεξάνδρου, Α. Βάρβογλη, Δ. Νικολαΐδη: Χημεία Ετεροχημικών Ενώσεων, Θεσσαλονίκη 1985