Προπενάλη
Πρότυπο:Πληροφορίες χημικής ένωσης
Η προπενάλη[1] ή ακρολεΐνη (Πρότυπο:Lang-en) είναι οργανική χημική ένωση, που περιέχει άνθρακα, οξυγόνο και υδρογόνο, με μοριακό τύπο C3H4O, αν και συχνά γράφεται πιο αναλυτικά ως CH2=CHCHO ή και (συντομογραφικά) ViCHO. Είναι η απλούστερη ακόρεστη αλδεΰδη. Η χημικά καθαρή προπανάλη, στις συνηθισμένες συνθήκες, δηλαδή σε θερμοκρασία 25 °C και πίεση 1 atm), είναι άχρωμο υγρό με διαπεραστική, δυσάρεστη και ερεθιστική οσμή. Η γνωστή οσμή καμένου λίπους, όπως για παράδειγμα όταν μαγειρικό λάδι θερμαίνεται ως τη θερμοκρασία στην οποία αρχίζει να καπνίζει, παράγεται (κυρίως) όταν η γλυκερίνη του λίπους (τριγλυκερίδιο) διασπάται θερμικά σε προπενάλη. Από την ιδιότητα αυτή πήρε και την εμπειρική της ονομασία «ακρολεΐνη», που προέρχεται από τη λατινική έκφραση «acre oleum», που μεταφράζεται στα ελληνικά ως «δριμύ λάδι», εξαιτίας τη χαρακτηριστικής δριμείας οσμής της, που ονομάζουμε «τσίκνα». Παράγεται βιομηχανικά από το προπένιο και χρησιμοποιήθηκε κυρίως ως βιοκτόνο και ως πρόδρομη ένωση για την παραγωγή άλλων χημικών ενώσεων, που συμπεριλαμβάνουν το αμινοξύ μεθειονίνη.
Ισομέρεια
Με βάση τον μοριακό της τύπο, C3H4O, έχει τα ακόλουθα δώδεκα (12) ισομερή θέσης:
- 1-προπινόλη (ελάσσων ταυτομερές της προπενόνης) με σύντομο συντακτικό τύπο CH3C ≡ COH.
- 2-Προπινόλη με σύντομο συντακτικό τύπο HC ≡ CCH2OH.
- Προπαδιενόλη (ελάσσων ταυτομερές της προπενάλης) με σύντομο συντακτικό τύπο H2C=C=CHOH.
- 1-κυκλοπροπενόλη (ελάσσων ταυτομερές της κυκλοπροπανόνης) με σύντομο συντακτικό τύπο
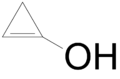
- 2-κυκλοπροπενόλη με σύντομο συντακτικό τύπο

- Αιθινυλομεθυλαιθέρας ή μεθοξυαιθίνιο με σύντομο συντακτικό τύπο HC ≡ COCH3.
- Οξετένιο ή 1,3-εποξυπροπένιο με σύντομο συντακτικό τύπο
 .
. - Μεθυλοξιρένιο ή 1,2-εποξυπροπένιο με σύντομο συντακτικό τύπο
 .
. - Μεθυλενοξιράνιο ή 2,3-εποξυπροπένιο με σύντομο συντακτικό τύπο
 .
. - Οξαδικυκλοβουτάνιο ή εποξυκυκλοπροπάνιο με σύντομο συντακτικό τύπο
 .
. - Προπενόνη ή μεθυλοκετένη (κύριο ταυτομερές της 1-προπινόλης) με σύντομο συντακτικό τύπο CH3CH=C=O.
- Κυκλοπροπανόνη (κύριο ταυτομερές της 1-κυκλοπροπενόλης) με σύντομο συντακτικό τύπο

Παραγωγή
Βιομηχανική
Η προπενάλη παράγεται βιομηχανικά με (μερική) οξείδωση προπενίου. Αυτή η διεργασία χρησιμοποιεί τον ατμοσφαιρικό αέρα ως πηγή οξυγόνου και χρειάζεται οξείδια μετάλλων ως ετερογενείς καταλύτες[2]:
Περίπου 500.000 τόνοι προπενάλης παράγονται ετησίως στη Βόρεια Αμερική, στην Ευρώπη και στην Ιαπωνία. Επιπρόαθετα, όλο το προπενικό οξύ παράγεται μέσω αντίστοιχης μετατροπής της προπενάλης. Η κύρια πρόκληση, μάλιστα, της παραπάνω αναφερόμενης οξείδωσης είναι ότι συχνά γίνεται απευθείας οξείδωση του προπενίου σε προπενικό οξύ. Επίσης το προπάνιο είναι υπό έρευνα για να αντικαταστήσει το προπένιο ως πρόδρομη ένωση της προπενάλης και του προπενικού οξέος.
Επίσης, όταν η γλυκερίνη θερμαίνεται στους 280 °C, διασπάται σε προπενάλη. Αυτή η μέθοδος παραγωγής είναι ελκυστική όταν η γλυκερίνη συμπαράγεται (ως παραπροϊόν) κατά την παραγωγή βιοντήζελ από λιπαρά οξέα:
Η αφυδάτωση της γλυκερίνης έχει επιδειχθεί, αλλά δεν έχει αποδειχθεί ανταγωνιστική ως οικονομικά βιώσιμη μέθοδος παραγωγής προπενάλης για τις πετροχημικές βιομηχανίες[3].
Η παραδοσιακή βιομηχανική οδός παραγωγής προπενάλης, που αναπτύχθηκε από την πρώην Γερμανική εταιρία Degussa, περιλάμβανε συμπύκνωση μεθανάλης και αιθανάλης:
Εργαστηριακή μέθοδος
Η προπενάλη μπορεί να παραχθεί σε εργαστηριακό επίπεδο με αφυδάτωση γλυκερίνης με θειικό κάλιο[4]:
Εναλλακτικές μέθοδοι
Με επίδραση βινυλομαγνησιοαλογονίδιου σε φορμικό εστέρα
Με επίδραση βινυλομαγνησιοαλογονίδιου (CH2=CHMgX) σε φορμικό εστέρα[5]:
Με μερική οξείδωση 2-προπεν-1-όλης
Με μερική οξείδωση 2-προπεν-1-όλης, με σχετικά ήπια οξειδωτικά μέσα, όπως το τριοξείδιο του χρωμίου[6]:
Με αφυδάτωση 3-υδροξυπροπανάλης
Με ενδομοριακή αφυδάτωση 3-υδροξυπροπανάλης παράγεται προπενάλη. Η αντίδραση ευνοείται σε σχετικά υψηηλές θερμοκρασίες, >150 °C[7]:
Με απόσπαση υδραλογόνου από 3-αλοπροπανάλη
Με απόσπαση υδραλογόνου (HX) από 3-αλοπροπανάλη (XCH2CH2CHO) παράγεται προπενάλη[8]:
Με απόσπαση αλογόνου από 2,3-διαλοπροπανάλη
Με απόσπαση αλογόνου (X2) από 2,3-διαλοπροπανάλη (XCH2CHXCHO) παράγεται προπενάλη[9]:
Με μερική καταλυτική υδρογόνωση προπινάλης
Με μερική καταλυτική υδρογόνωση προπινάλης παράγεται προπενάλη[10]
Χημικές ιδιότητες και παράγωγα
Η προπενάλη είναι μια σχετικά ηλεκτρονιόφιλη χημικά δραστική και γι' αυτό πολύ τοξική ένωση. Είναι καλός δέκτης Μίχαελ (Michael acceptor) και γι' αυτό χρήσιμη για αντιδράσεις με θειόλες. Σχηματίζει γρήγορα ακετάλες. Ένα ενδιαφέρον τέτοιο παράγωγο από πενταερυθριτόλη είναι η διαλλυλιδενοπενταερυθριτόλη, μια σπειροκυκλική ένωση. Η προπενάλη παίρνει μέρος σε πολλές αντιδράσεις Ντίελς - Άλντερ (Diels-Alder reactions), ακόμη και με τον εαυτό της. Μέσω των αντιδράσεων αυτών, η προπενάλη είναι πρόδρομη ένωση για κάποιες εμπορικά χρήσιμα αρώματα, που συμπεριλαμβάνουν τη λυράλη, τη νορμπορνεν-2-καρβοξαλδεΰδη και τη μυρακαλδεΰδη[11].
Ταυτομέρεια με προπαδιενόλη
Η αιθενάλη βρίσκεται πάντα σε χημική ισορροπία με την ταυτομερή της προπαδιενόλη. Μπορεί να καταλυθεί προς την επιθυμητή κατεύθυνση με παρουσία οξέων ή βάσεων[12]:
Αναγωγή
Μπορεί να αναχθεί προς προπανάλη ή και προς 1-προπανόλη με τις ακόλουθες μεθόδους[13]
1. Με λιθιοαργιλιοϋδρίδιο (LiAlH4). Είναι ισχυρό αναγωγικό κι έτσι προκύπτει απευθείας προπανάλη-1:
2. Με καταλυτική υδρογόνωση. Είναι δυνατή μερική, προς προπανάλη, αλλά με περίσσεια υδρογόνου σχηματίζεται 1-προπανόλη:
3. Μπορεί να αναχθεί προς προπένιο με τη μέθοδο Wolff-Kishner[14]
Οξείδωση προς προπενικό οξύ
Μπορεί να οξειδωθεί προς προπενικό οξύ[15];
1. Με υπερμαγγανικό κάλιο:
2. Με τριοξείδιο του χρωμίου:
3. Με αντιδραστήριο Tollens (αμμωνιακό διάλυμα νιτρικού αργύρου):
4. Με αντιδραστήρια Fehling:
- Οι αντιδράσεις 3-4 παρουσιάζονται απλοποιημένες και χρησιμοποιούνται γενικά για την ανίχνχνευση αλδεϋδομάδας (-CHO).
Προσθήκη ύδατος
Με προσθήκη ύδατος σε 2-προπενάλη παράγεται αρχικά, σε χημική ισορροπία, η μη απομονώσιμη ασταθής 2-προπεν-1,1-διόλη και στη συνέχεια, με περίσσεια ύδατος 1,1,2-προπανοτριόλη, σε χημική ισορροπία με την αφυδατωμένη 2-υδροξυπροπανάλη[16]:
Προσθήκη 1,2-αιθανοδιόλης
Με προσθήκη 1,2-αιθανοδιόλης παράγεται 2-βινυλο-1,3-διοξολάνιο[17]:
2-βινυλο-1,3-διοξολάνιο
Προσθήκη 1,2-αιθανοδιθειόλης
Με προσθήκη 1,2-αιθανοδιθειόλης παράγεται 2-βινυλο-1,3-διθειολάνιο[17]:
2-βινυλο-1,3-διθειολάνιο
- Το 2-βινυλο-1,3-διθειολάνιο μπορεί να υποστεί αποθείωση Raney με νικέλιο και υδρογόνο, σχηματίζοντας προπάνιο και αιθάνιο:
2-βινυλο-1,3-διθειολάνιο
Αντιδράσεις με αζωτούχες ενώσεις
Αντιδρά με αρκετά είδη αζωτούχων ενώσεων του γενικού τύπου NH2A, όπου το A μπορεί να είναι υδρογόνο, αλκύλιο, υδροξύλιο, αμινοξάδα και διάφορα άλλα. Με βάση τον γενικό τύπο η γενική αντίδραση είναι η ακόλουθη[18]:
- Μερικά σχετικά παραδείγματα αμέσως παρακάτω:
1. Με αμμωνία παράγεται 2-προπενιμίνη. Προκύπτει από την παραπάνω γενική με A = H:
2. Με πρωτοταγείς αμίνες (RNH2) παράγεται Ν-αλκυλο-2-προπενιμίνη. Προκύπτει από την παραπάνω γενική με A = R:
3. Με υδροξυλαμίνη παράγεται 2-προπενοξίμη. Προκύπτει από την παραπάνω γενική με A = OH:
4. Με υδραζίνη παράγεται αρχικά 2-προπενυδραζόνη και με περίσσεια 2-προπενάλης δι(2-προπενυλιδεν)αζίνη. Προκύπτει από την παραπάνω γενική με A = NH2:
5. Με φαινυλυδραζίνη παράγεαι 1-(2-προπενυλιδενο)-2-φαινυλυδραζόνη. Προκύπτει από την παραπάνω γενική με A = NHPh::
6. Με υδραζινομεθαναμίδιο παράγεται (2-(2-προπενυλιδεν)υδραζινο)μεθαναμίδιο. Προκύπτει από την παραπάνω γενική με A = NCONH2:
Συμπύκνωση με δευτεροταγείς αμίνες
Με επίδραση δευτεροταγούς αμίνης (RNHR') παράγεται αρχικά 1-(διαλκυλαμινο)-2-προπεν-1-όλη, η οποία στη συνέχεια με αφυδάτωση μπορεί να δώσει Ν,Ν-διαλκυλο-1,2-προπαδιεν-1-αμίνη[19]:
Αλδολική συμπύκνωση
Με επίδραση βάσης έχουμε τη λεγόμενη αλδολική συμπύκνωση, η οποία όταν γίνεται με τον εαυτό της, παράγεται αρχικά 2-μεθυλενο-3-υδροξυ-4-πεντενάλη, η οποία στη συνέχεια με αφυδάτωση μπορεί να δώσει 2-μεθυλενο-3,4-πενταδιενάλη[20]:
Συμπύκνωση με «ενεργές» μεθυλενομάδες
Με την επίδραση «ενεργών» μεθυλενομάδων, δηλαδή ενώσεων του γενικού τύπου XCH2Y, όπου X,Y ηλεκτραρνητικές ομάδες όπως π.χ. κυανομάδα (CN), καρβαλκοξυομάδα (COOR), έχουμε την αντίδραση Knoevenagel[21]:
Συμπύκνωση με α-αλεστέρες
Με επίδραση α-αλεστέρων (R'CHXCOOR) έχουμε την αντίδραση Darzen, κατά την οποία τελικά παράγεται 2-βινυλο-1-καρβαλκοξυοξιράνιο. Π.χ. με αλαιθανικό αλκυλεστέρα (XCH2COOR) έχουμε[22]:
2-βινυλο-1-καρβαλκοξυοξιράνιο
Επίδραση φωσφοροϋλιδίων
Με επίδραση φωσφοροϋλιδίων [Ph3P+C-(R)R'] έχουμε τη λεγόμενη αντίδραση Wittig, με την οποία παράγεται 1,1-διαλκυλο-1.2-βουταδιένιο[23]:
Προσθήκη διαφόρων πυρηνόφιλων αντιδραστηρίων
Είναι δυνατή η προσθήκη διαφόρων πυρηνόφιλων αντιδραστηρίων στους διπλούς δεσμούς C=C ή και C=Ο που περιέχει η προπενάλη. Π.χ.:[24]:
1. Με προσθήκη υδροκυανίου παράγεται αρχικά 2-υδροξυ-3-βουτενονιτρίλιο, στη συνέχεια με περίσσεια υδροκυανίου, 3-μεθυλο-2-υδροξυβουτανοδινιτρίλιο, από το οποίο με υδρόλυση μπορεί να παραχθεί 3-μεθυλο-2-υδροξυβουτανοδιικό οξύ:
2. Με προσθήκη όξινου θειικού νατρίου παράγεται 1-υδροξυ-2-προπεν-1-σουλφονικό οξύ:
3. Με προσθήκη αλκυλομαγνησιοαλογονιδίου (RMgX) παράγεται 1,2-διαλκυλο-1-προπανόλη:
4. Με προσθήκη πενταχλωριούχου φωσφόρου παράγεται 1,1,2,3-τετραχλωροπροπάνιο:
Επίδραση υδραζωτικού οξέος
Με επίδραση υδραζωτικού οξέος (αντίδραση Achmidt) παράγεται προπενονιτρίλιο και N-προπυλιδενιμινομεθανάλη[25]:
Εφαρμογές
Ως βιοκτόνο
Η προπενάλη χρησιμοποιήθηκε ως ζιζανιοκτόνο επαφής για τον έλεγχο υποβρύχιων και επιπλεόντων ζιζανίων, όπως φυκών σε κανάλια άρδευσης. Χρησιμπποιήθηκε στα επίπεδα των 10 ppm στην άρδευση και σε ανακυκλούμενα ύδατα. Στη βιομηχανία εξόρυξης πετρελαίου και φυσικού αερίου χρησιμοποιήθηκε ως βιοκτόνο για τα ύδατα εξόρυξης, καθώς και για την εξουδετέρωση του υδρόθειου και των θειολών[11].
Ως πρόδρομη ένωση
Ένας αριθμός χρήσιμων ενώσεων παράγονται από προπενάλη. Για την παραγωγή τους αξιοποιείται η παρουσία δύο (2) λειτουργικών ομάδων σε αυτήν (διπλός δεσμός C=C και αλδεϋδομάδα). Το αμινοξύ μεθειονίνη παράγεται από προπενάλη με προσθήκη μεθανοθειόλης, ακολουθούμενη από αντίδραση Στρέκερ (Strecker synthesis). Η προπενάλη συμπυκνώνεται με αιθανάλη και αμίνες δίνοντας μεθυλοπυριδίνες. Η προπενάλη πολυμερίζεται παρουσία οξυγόνου και στο νερό σε συγκεντρώσεις πάνω από 22%. Το χρώμα και η υφή του παραγώμενου πολυμερούς εξαρτάται από τις συνθήκες πολυμερισμού. Με την πάροδο του χρόνου αυτοπολυμερίζεται σχηματίζοντας ένα καθαρό κίτρινο στερεό πολυμερές. Μέσα σε νερό παράγει ένα σκληρό πορώδες πλαστικό. Μερικές φορές η προπενάλη χρησιμοποιήθηκε ως ακινητοποιητής, για την προετοιμασία βιολογικών δειγμάτων για μελέτη με ηλεκτρονικό μικροσκόπιο[26].
Αναφορές και σημειώσεις
- ↑ Συχνά γράφεται ως 2-προπενάλη, αλλά ο αριθμός θέσης στην ένωση αυτή αποτελεί πλεονασμό, αφού δεν υπάρχει άλλη προπενάλη. Η «μετακίνηση» του δεσμού στο #1 άτομο άνθρακα δίνει την προπενόνη, που είναι μια κετένη, που θεωρείται ότι ανήκει στις κετόνες.
- ↑ Dietrich Arntz, Achim Fischer, Mathias Höpp, Sylvia Jacobi, Jörg Sauer, Takashi Ohara, Takahisa Sato, Noboru Shimizu and Helmut Schwind "Acrolein and Methacrolein" in Ullmann's Encyclopedia of Industrial Chemistry, 2012, Wiley-VCH, Weinheim. Πρότυπο:DOI
- ↑ Andreas Martin, Udo Armbruster, Hanan Atia "Recent developments in dehydration of glycerol toward acrolein over heteropolyacids" European Journal of Lipid Science and Technology 2012, Volume 114, pages 10–23. doi:10.1002/ejlt.201100047.
- ↑ Homer Adkins and W. H. Hartung (1941), "Acrolein", Org. Synth.; Coll. Vol. 1: 15
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.216, §9.2.1.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.216, §9.2.2.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.153, §6.3.3.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.153, §6.3.1α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.153, §6.3.1β.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.158, §6.9.4.
- ↑ 11,0 11,1 Dietrich Arntz, Achim Fischer, Mathias Höpp, Sylvia Jacobi, Jörg Sauer, Takashi Ohara, Takahisa Sato, Noboru Shimizu and Helmut Schwind "Acrolein and Methacrolein" in Ullmann's Encyclopedia of Industrial Chemistry, 2012, Wiley-VCH, Weinheim. doi:10.1002/14356007.a01_149.pub2
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.218, §9.5.1.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.218, §9.5.2.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.218, §9.5.3α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.221, §9.6.1,2.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.218, §9.5.5α.
- ↑ 17,0 17,1 Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.218, §9.5.5β.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.218-219, §9.5.6.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.219, §9.5.7.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.219, §9.5.8. και SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999, σελ. 268, §15.3.8
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.219, §9.5.9.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.219, §9.5.10.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.219, §9.5.11.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.220, §9.5.12.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.220, §9.5.15.
- ↑ M J Dykstra, L E Reuss (2003) Biological Electron Microscopy: Theory, Techniques, and Troubleshooting. Springer, ISBN 0-306-47749-1, ISBN 978-0-306-47749-2.
Πηγές
- Γ. Βάρβογλη, Ν. Αλεξάνδρου, Οργανική Χημεία, Αθήνα 1972
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982
- Δημήτριου Ν. Νικολαΐδη: Ειδικά μαθήματα Οργανικής Χημείας, Θεσσαλονίκη 1983.
